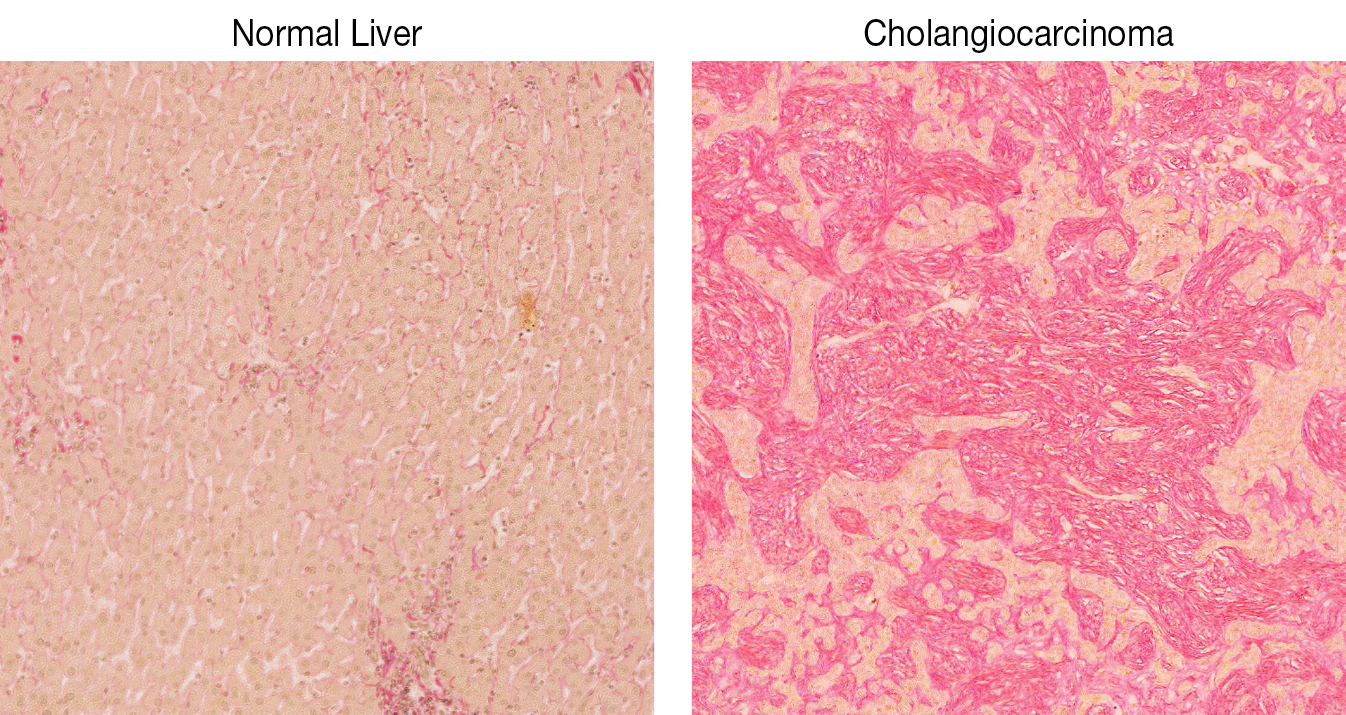
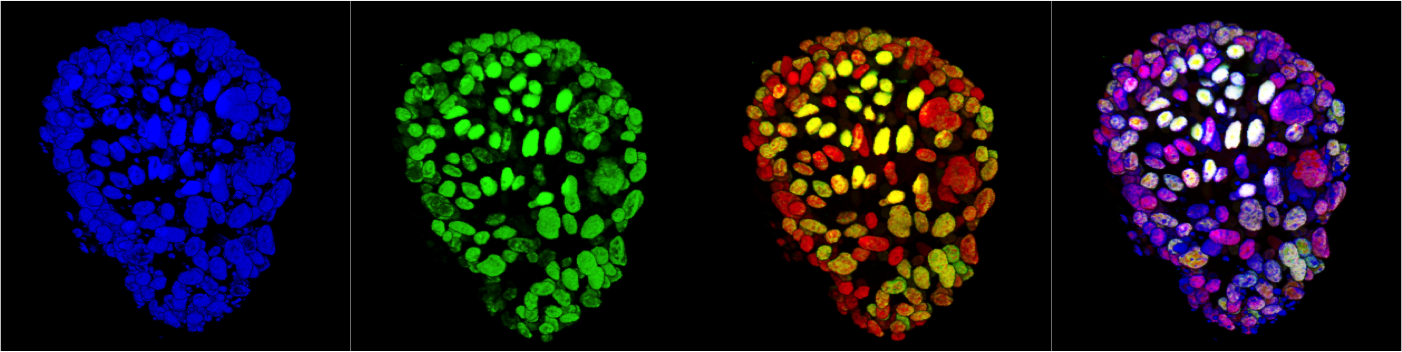
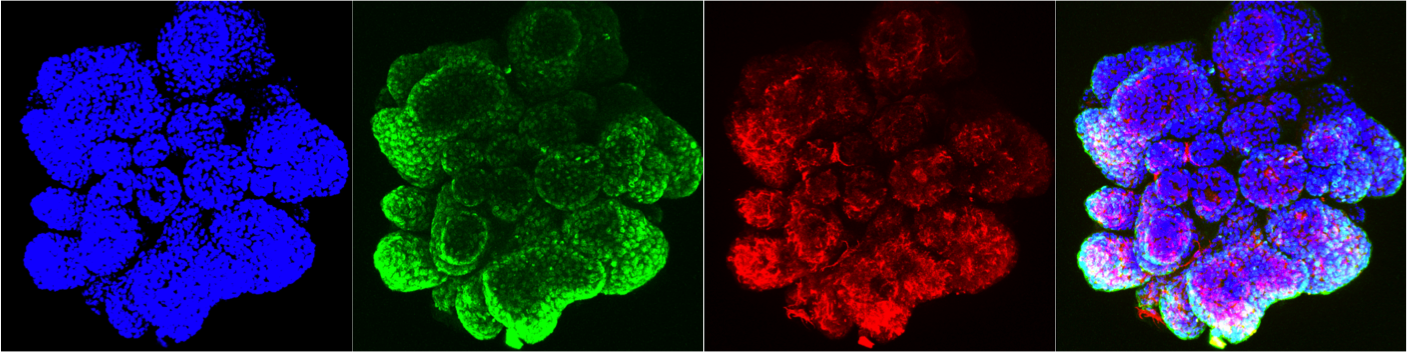
Biologia dei tessuti e tumorigenesi
I nostri tessuti sono composti da una rete di cellule tenute insieme da una matrice extracellulare a cui aderiscono e che svolge un ruolo fondamentale nell'organizzazione di ogni tessuto. All'interno dei tessuti, le cellule presentano comportamenti "sociali" straordinari e tuttavia misteriosi. Esempi evidenti di tali comportamenti sono la capacità di arrestare la proliferazione quando entrano in contatto fisico tra loro, di modificare il proprio destino per andare incontro alle necessità del tessuto o di riorganizzarsi in nuovo tessuto durante la riparazione di organi danneggiati. I tessuti sani possono anche riconoscere singole cellule tumorali ed eliminarle o "normalizzarne" il comportamento, domando in questo modo l'effetto delle mutazioni oncogene.
Questi sistemi di rilevamento e di controllo sono completamente sovvertiti nei tumori solidi, a vantaggio dell'espansione delle cellule tumorali. L'obiettivo finale del nostro gruppo di ricerca è l'elaborazione di strategie per l'eradicazione di tumori e delle loro metastasi attraverso la riattivazione di tali meccanismi di sorveglianza. Per questo motivo ci interroghiamo sulla natura dei comportamenti "sociali" ed "antisociali" dimostrati dalle cellule nel contesto tissutale.
Negli ultimi 40 anni la ricerca sul cancro è stata condotta quasi esclusivamente dal punto di vista del cancro come malattia genetica. Tuttavia, la soppressione tumorale a livello di tessuto non è qualcosa direttamente codificato nei nostri geni, proprio in quanto proprietà esclusiva di un "sistema" di cellule, e non della singola cellula. Per comprendere il controllo del comportamento cellulare a livello tissutale è quindi necessario abbracciare nuovi paradigmi, capaci di farci capire come le cellule integrino tante informazioni che emanano dalla struttura propria e del proprio intorno. Per esempio, sappiamo pochissimo su come ogni singola cellula venga informata in tempo reale in merito a ciò che succede a cellule molto distanti dello stesso organo, o su come ogni cellula sia allineata con i parametri fisici della matrice a cui aderisce, legga la propria forma e le caratteristiche architettoniche proprie del tessuto che la ospita.
In questi anni, abbiamo contribuito all'avanzamento in questo campo con la scoperta che YAP/TAZ - due proteine di regolazione dell'espressione genica altamente correlate - fungono da sensori della capacità percettiva delle cellule connesse all'interno del tessuto, di sé stesse e del loro ambiente. A differenza di tutti gli altri segnali finora conosciuti, l'attività di YAP/TAZ dipende fortemente proprio dalla forma della cellula e più in generale, da input di tipo fisico (durezza ed elasticità della matrice extracellulare) e meccanici e sono influenzati dall'attaccamento della cellula ad altre cellule. Recentemente abbiamo scoperto che l'attivazione di YAP/TAZ è in grado di fornire alle cellule molti dei "super-poteri" tipici delle cellule staminali. Nel cancro ciò si traduce nella generazione di nuove cellule cancerogene, aggressività del tumore, chemioresistenza e metastasi. YAP/TAZ sono essenziali per la tumorigenesi nella maggior parte dei tumori solidi e sono diffusamente attivati nelle forme maligne umane, rendendo la biologia di YAP/TAZ un bersaglio ideale per la terapia del cancro. Fin dalla sua fondazione, l'IFOM è stato concepito come una rete di scienziati provenienti dai principali centri scientifici italiani. In questo senso, il nostro gruppo opera in sinergia con il Dipartimento di Medicina Molecolare della scuola di Medicina dell'Università di Padova, una tra le principali istituzioni di ricerca biomedica italiane. Il razionale del nostro studio riflette la visione di IFOM che, al fine di sviluppare approcci curativi innovativi, sia necessario comprendere la biologia del cancro a livello di sistema. Il nostro lavoro è in continuità con quanto perseguito da altri gruppi in IFOM su tematiche di "Meccano-oncologia", e sinergici con tali sforzi.
Perseguiamo un approccio multidisciplinare partendo dall'analisi di pazienti oncologici, passando per l'uso di organoidi da tumori umani (in un'ottica di medicina personalizzata), e dedicando molti sforzi alla modellizzazione di tumori aggressivi umani, dei loro meccanismi e del loro trattamento.
Perseguiamo tre principali direzioni di ricerca:
- Comprendere in che modo il contesto tissutale e in particolare i segnali meccanici interagiscono con le lesioni genetiche (i.e., oncogeni) tipici delle cellule tumorali per regolarne il comportamento. I quesiti che ci poniamo includono: gli oncogeni consentono alle cellule che ne sono portatrici di disobbedire ai segnali meccanici di freno della crescita dei tessuti normali circostanti? Fino a che punto i tumori e le metastasi dipendono dalla meccanotrasduzione cellulare? Siamo in grado di arrestare la crescita tumorale nelle cellule viventi agendo sulla modulazione delle forze meccaniche normalizzandole a quelle del tessuto sano?
- Comprendere la plasticità delle cellule normali e del cancro e delle sue radici epigenetiche. I tumori originalmente sono stati descritti come "ferite che non guariscono mai", mettendo in evidenza l'insorgere del tumore come un dirottamento di antichi meccanismi di riparazione del tessuto. Quali sono i determinanti molecolari in comune tra la crescita tumorale e la ricrescita di organo durante il danno tissutale? Quali sono le differenze? Possiamo sfruttare la plasticità cellulare per indurre la rigenerazione dei tessuti distrutti dalla malattia, o, agendo in direzione opposta, per staccare la spina ai meccanismi che rinvigoriscono costantemente il tumore.
- Studiare il modo in cui la combinazione di segnali chimici e meccanici generano nicchie speciali che alimentano la progressione tumorale, le metastasi e la chemioresistenza. Ciò include l'esaminazione di organoidi tumorali umani da cancri incurabili, e la loro convalida come "avatar in provetta" della malattia umana.
Photogallery
 Mammary gland organoid
Mammary gland organoid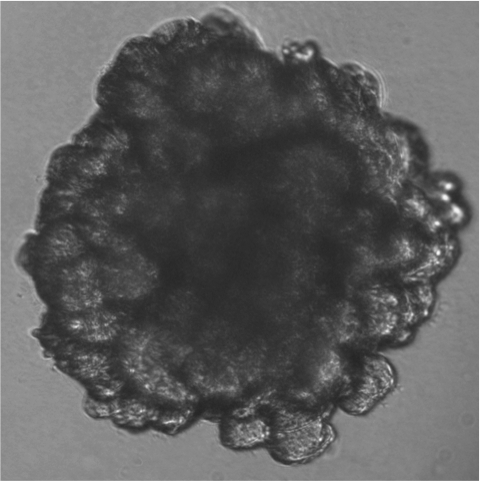 Human breast cancer organoid
Human breast cancer organoid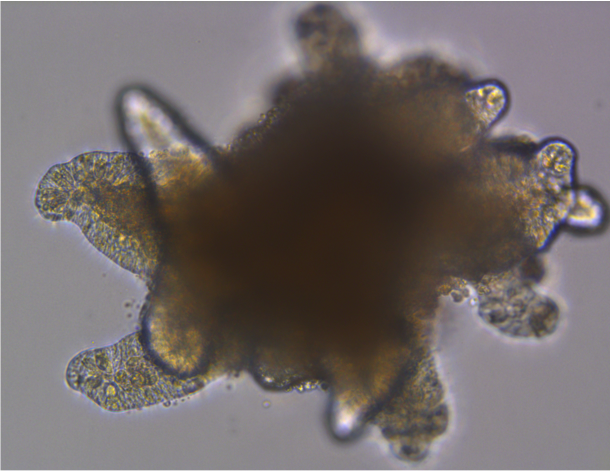 Intestinal Organoids
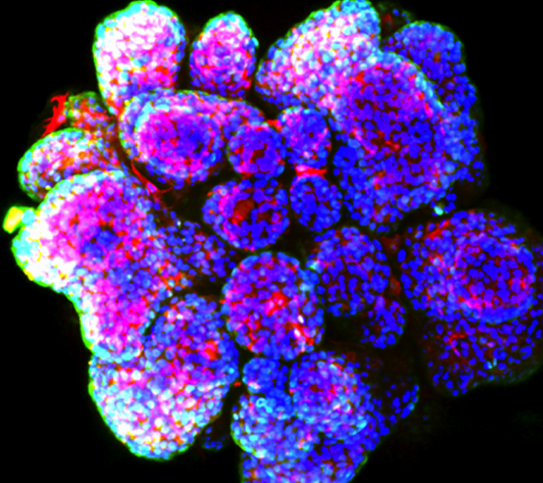
Intestinal Organoids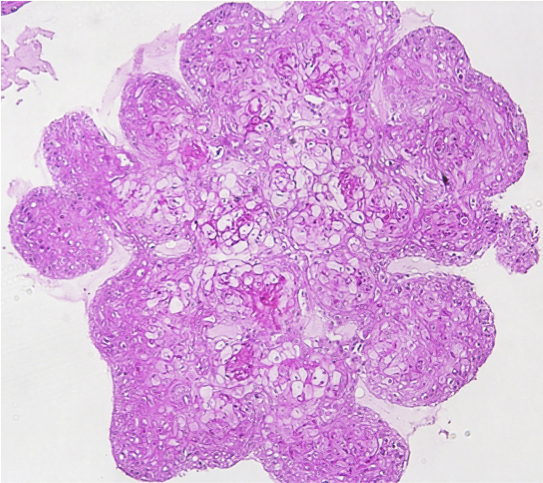 Human breast cancer organoid
Human breast cancer organoid