Linfomi: ricerca italiana svela la loro complessità e raccomanda l’uso di terapie combinate
Milano, 2 giugno 2017
Individuati da un team di ricercatori dell’IFOM di Milano alcuni meccanismi attraverso i quali la proteina BCR controlla la crescita di forme aggressive di linfoma non-Hodgkin. I risultati indicano l’opportunità di monitorare con un semplice test di laboratorio l’espressione di BCR nelle cellule tumorali a partire dalla diagnosi. I nuovi dati indicano anche come migliorare le attuali terapie per la cura di diverse forme di linfomi e leucemie, proponendo approcci terapeutici basati su combinazioni di farmaci La ricerca, i cui risultati sono pubblicati sulle pagine dell’autorevole rivista scientifica Nature, è stata possibile grazie al sostegno della Fondazione Armenise-Harvard e di AIRC.
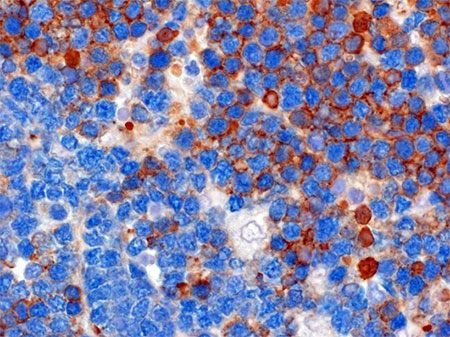 La colorazione marroncina rivela l’espressione sulla superficie delle cellule tumorali del BCR. Il colore azzurro rivela un marcatore cellulare comune sia alle cellule tumorali BCR+ e BCR negative.
La colorazione marroncina rivela l’espressione sulla superficie delle cellule tumorali del BCR. Il colore azzurro rivela un marcatore cellulare comune sia alle cellule tumorali BCR+ e BCR negative. I linfomi sono tumori del sangue che colpiscono comunemente uno dei principali attori del sistema immunitario: i linfociti B.
Reclutati per difenderci dall'attacco di agenti quali virus e batteri, i linfociti B riconoscono gli intrusi catturandoli grazie a recettori esposti sulla loro superficie, detti immunoglobuline (o BCR, da B cell receptor). L’intercettazione di patogeni da parte del BCR stimola i linfociti a proliferare e quindi a rilasciare forme solubili delle stesse immunoglobuline che facilitano la rapida neutralizzazione dell’agente infettivo.
I linfociti B, mentre proliferano in risposta a un virus o batterio, acquisiscono mutazioni "benigne" a carico dei geni del BCR, necessarie a migliorare l’efficienza nel legare e neutralizzare il patogeno. Questo processo, non scevro da errori, può, a bassa frequenza, causare mutazioni in geni diversi dal BCR, che occasionalmente provocano l’insorgenza di linfomi o leucemie.
In queste forme tumorali, il BCR rimane espresso sulla superficie dei linfociti B neoplastici, favorendone la crescita. Ciò ha reso il BCR, un bersaglio elettivo della terapia di diverse forme di linfoma non-Hodgkin, nonché della leucemia linfatica cronica, la forma più comune di leucemia dell’adulto. Stefano Casola, medico ricercatore direttore del programma "Immunologia molecolare e biologia dei linfomi" dell’IFOM di Milano, e rientrato in Italia grazie al supporto della Fondazione Armenise-Harvard, è autore insieme al suo gruppo dello studio pubblicato oggi sull’autorevole rivista Nature. I risultati dello studio mettono in guardia dai potenziali rischi di terapie anti-BCR, svelando, allo stesso tempo, strategie per rendere tali terapie più efficaci. Studiando in topi di laboratorio il linfoma di Burkitt, una forma aggressiva di linfoma non-Hodgkin, i ricercatori hanno notato che cellule tumorali private del BCR continuavano sorprendentemente a crescere. Viceversa, le stesse soccombevano rapidamente quando conservavano il BCR. I risultati hanno portato a ipotizzare che il BCR avvantaggi le cellule di linfoma che lo esprimono e allo stesso tempo freni la crescita di quelle che lo perdono. Grazie alla consolidata e proficua collaborazione con il professor Fabio Facchetti dell’Università di Brescia, e il professor Maurilio Ponzoni dell’Università Vita-Salute San Raffaele di Milano, si è rapidamente passati dallo studio in topi di laboratorio all’analisi di campioni umani di linfoma di Burkitt.
"I risultati osservati nei topi di laboratorio ci hanno entusiasmato e spronato immediatamente a verificare l’esistenza di un meccanismo analogo nei corrispondenti linfomi umani - commenta Ponzoni -, e questo nonostante i risultati non fossero del tutto in linea con quanto finora universalmente accettato". "Analizzando un’ampia casistica di biopsie di linfoma di Burkitt rigorosamente selezionata con test genetico-molecolari e utilizzando metodiche di morfologia molecolare a multipli marcatori, è stato possibile dimostrare - aggiunge Fabio Facchetti - che una parte di questi tumori non esprimono il BCR, talora nella larga maggioranza delle cellule linfomatose, in altri casi in una frazione di esse." Sostenuto da queste osservazioni, Stefano Casola offre spunti di riflessione per nuove prospettive terapeutiche agli oncologi. "Mentre i farmaci anti-BCR inibiscono la maggioranza della popolazione tumorale di linfomi e leucemie che esprimono il BCR, essi rischiano paradossalmente di favorire la crescita di rare cellule tumorali prive del BCR, che a loro volta possono rendersi responsabili di una possibile ripresa della malattia".
Lo studio pubblicato su Nature fornisce indicazioni su come sia possibile evitare questo scenario. Grazie a studi in topi di laboratorio - chiarisce Casola - abbiamo identificato un tallone di Achille, per così dire, delle cellule di linfoma prive del BCR". "Abbiamo scoperto - continua Casola - che queste cellule sono particolarmente sensibili a stress nutrizionali, e questo le rende bersagli preferenziali di farmaci quali la rapamicina".
I risultati dello studio, se confermati in studi clinici prospettici, potrebbero portare alla revisione delle attuali procedure diagnostiche e terapeutiche di pazienti affetti da linfomi e leucemie a cellule B. Infatti, combinando un semplice test di laboratorio ad analisi istologiche su materiale ottenuto da biopsia o da un esame del sangue, si potrebbe monitorare lo stato del BCR nella popolazione delle cellule tumorali. Queste informazioni - conclude Casola - potrebbero aiutare l’oncologo a progettare terapie personalizzate in cui a inibitori farmacologici del BCR possano eventualmente essere abbinati farmaci quali la rapamicina per combattere la complessità e l’eterogeneità del tumore.
Questa ricerca non sarebbe stata possibile senza il contributo fondamentale, tra gli altri, della Fondazione Armenise-Harvard e dell’Associazione Italiana per la Ricerca sul Cancro (AIRC).
L’ARTICOLO
- TESTATA: Nature
- DATA DI PUBBLICAZIONE: 31 maggio 2017
- DOI: 10.1038/nature22353
- TITOLO: The B-cell receptor controls fitness of MYC-driven lymphoma cells via GSK3β inhibition
- AUTORI: Gabriele Varano1, Simon Raffel2, Martina Sormani1, Federica Zanardi1, Silvia Lonardi3, Christin Zasada4, Laura Perucho1, Valentina Petrocelli1, Andrea Haake5, Albert K. Lee6, Mattia Bugatti3, Ulrike Paul5, Eelco Van Anken7, Laura Pasqualucci8, Raul Rabadan6, Reiner Siebert5,9, Stefan Kempa4, Maurilio Ponzoni10, Fabio Facchetti3, Klaus Rajewsky4 and Stefano Casola1
1 IFOM, the FIRC Institute of Molecular Oncology, 20139 Milan, Italy
2 IFOM Genome Diagnostics Research Program, the FIRC Institute of Molecular Oncology 20139, Milan, Italy
2 Heidelberg Institute for Stem Cell Technology and Experimental Medicine, 69120 Heidelberg, Germany
3 Department of Molecular and Translational Medicine, Section of Pathology, University of Brescia, Spedali Civili, 25123, Brescia, Italy
4 Max-Delbrück-Center of Molecular Medicine in the Helmholtz Association, 13125, Berlin, Germany
5 Institute of Human Genetics, Christian-Albrechts-University Kiel, 24105 Kiel, Germany
6 Department of Systems Biology and Department of Biomedical Informatics, Columbia University, New York, New York, 10027, USA
7 Division of Genetics and Cell Biology, San Raffaele Scientific Institute, 20132 Milan, Italy
8 Institute for Cancer Genetics and the Department of Pathology and Cell Biology, Herbert Irving Comprehensive Cancer Center, Columbia University, New York, New York 10032, USA
9 Institute of Human Genetics, University Hospital of Ulm, 89081 Ulm, Germany
10 Università Vita-Salute San Raffaele and Scientific Institute, Pathology and Lymphoid Malignancies Units, 20132 Milan, Italy